LEUCEMIE MYELOIDE CHRONIQUE : 20 ANS APRES LA REVOLUTION THERAPEUTIQUE QUI A CHANGE LA VIE DES PATIENTS
Par le Professeur Ali TURHAN, Chef du Service d'hématologie Bicêtre et Paul Brousse, Directeur Unité INSERM UA09 - Villejuif
C'est uniquement grâce à vos dons que nous pouvons financer la recherche contre la leucémie myéloïde chronique pour permettre de combattre les résistances aux traitements et les rechutes et aider les patients atteints de cancer. Nous avons besoin de votre aide. "j'agis, je fais un don"

INTRODUCTION
La leucémie myéloïde chronique (LMC) est une affection maligne de la cellule souche hématopoïétique avec une prolifération incontrôlée de certaines populations sanguines. L’histoire naturelle se caractérise par une progression de la maladie vers une leucémie aigue mortelle entre 3-5 ans après le diagnostic. Cette histoire naturelle a été modifiée par la disponibilité de nouvelles thérapies dites « ciblées » car touchant surtout les cellules leucémiques malignes et représente historiquement, un « success story » majeur en Cancérologie. La LMC est connue de longue date, les premières descriptions datant du 19eme siècle. Les malades se présentaient par une augmentation majeure de la taille rate, qui s’accompagnait d’une prolifération des globules blancs au niveau du sang générant un « épaississement » de ce dernier, faisant suspecter une maladie infectieuse purulente. Cette maladie était mortelle dans les 2-3 ans suivant le diagnostic et elle l’est restée….jusqu’aux premières thérapies efficaces, comprenant la greffe de moelle dans les années 1970 et l’introduction de l’Interféron dans les années 1980, qui ont permis les premières réponses thérapeutiques sans effet majeur sur la survie.
La révolution de thérapies ciblées a eu lieu à la fin des années 1990, et qui a changé de manière définitive le pronostic et la vie de nos patients. Comme indiqué dans la Figure 1, les connaissances dues à la recherche ont joué un rôle majeur dans ce changement, chaque progrès s’enchainant avec l’autre et faisant intervenir de nombreuses équipes de recherche à travers le monde. Le tournant majeur dans cette histoire est sans aucun doute la découverte d’un petit chromosome dans les cellules leucémiques de patients atteints de LMC, par Peter Nowell et David Hungerford, qui était un étudiant en Thèse au centre de recherche Fox Chase à Philadelphie. Ils avaient en effet observé dans les cellules leucémiques de 2 patients, la présence d’un chromosome de petite taille qui n’existait que dans les cellules malignes. Cette anomalie était donc spécifique de cette leucémie et a été désigné par le terme de « Chromosome de Philadelphie ou Ph1). La confirmation de ces résultats sur un grand nombre de patients à travers le monde, a montré aussi le fait qu’il s’agissait du premier marqueur génétique jamais mis en évidence dans un cancer. Cette découverte réalisée en 1960 allait devenir le point de départ d’une activité de recherche intense dont les étapes sont intéressantes à analyser, mettant en évidence la complémentarité des recherches qui ont permis des progrès de manière exponentielle (Figure 1). Janet Rowley a découvert en 1974 que le Ph1 n’était pas un chromosome tronqué mais était le résultat d’un échange de matériel génétique réciproque entre deux chromosome (9 et 22). L’existence d’une portion venant du chromosome 9 sur le 22, allait permettre d’isoler cette région sous forme d’un « clonage » permettant ainsi son étude à la fois in vitro et in vivo chez les souris. En effet, ce gène anormal avec des portions venant des 2 chromosomes fusionnés, nommé BCR-ABL, était capables de générer une leucémie chez la souris, ne laissant aucun doute quant à sa responsabilité dans la survenue de la maladie. A partir de ces observations, les recherches se sont accentuées pour inhiber l’activité de ce gène, elles ont été facilitées par la présence de modèles in vitro et in vivo : Ainsi, elles ont abouti vers la fin des années 1990, à la mise au point des premières thérapies ciblées de la maladie. Ce délai extrêmement court de 10 ans environ, (un record) entre l’identification du gène anormal et les premières thérapies, représente un succès majeur en Cancérologie et qui a servi de modèle à plusieurs autres thérapies ciblées développées depuis pour d’autres cancers.

LEUCEMIE MYELOIDE CHRONIQUE A L’ERE DES THERAPIES CIBLEES
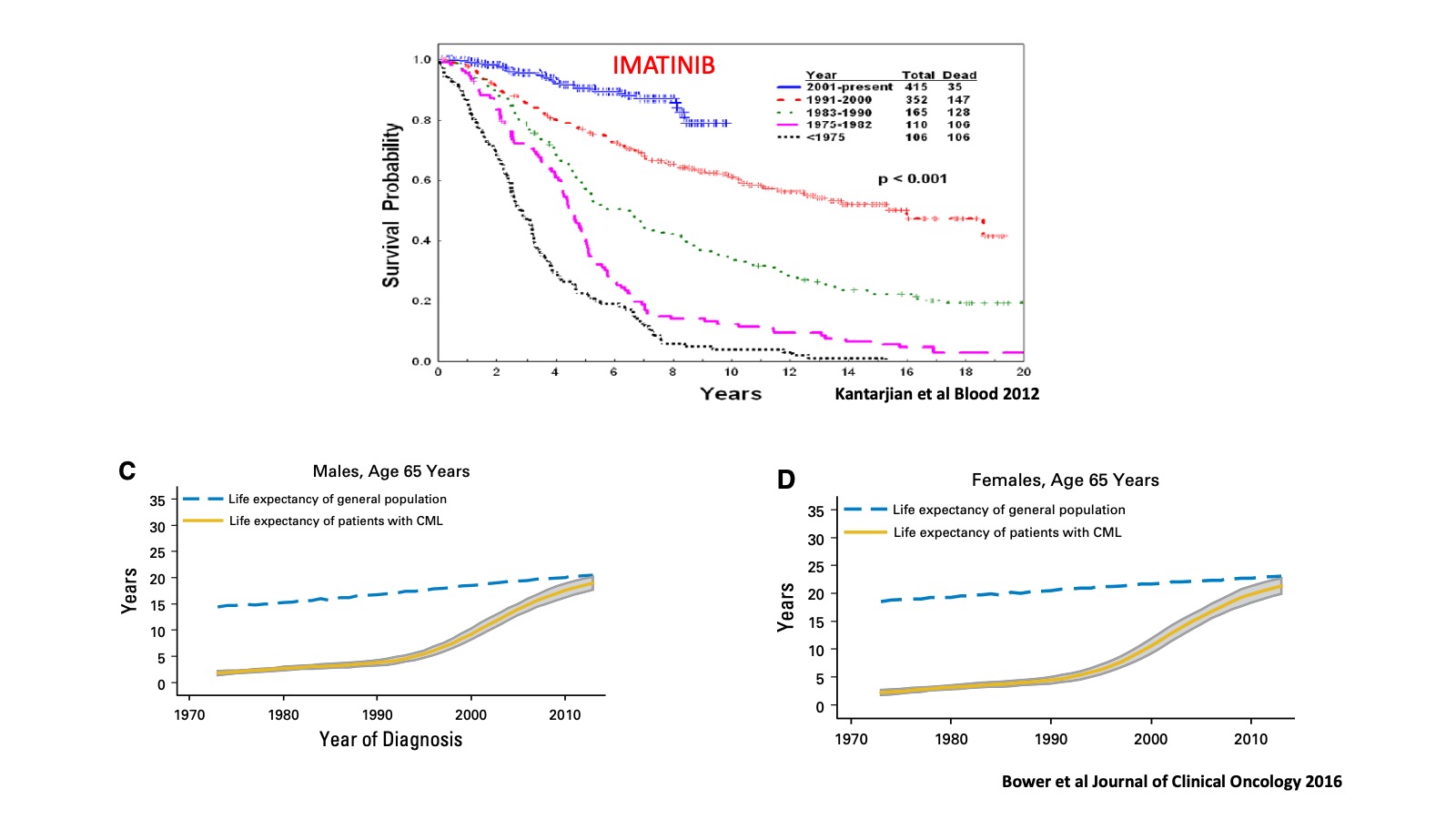
La disponibilité des thérapies ciblées a révolutionné la prise en charge des patients atteints de LMC. Comme indiqué précédemment, ces thérapies ont permis une augmentation majeure de la survie des patients et permettent aujourd’hui, d’évoquer la guérison, dans cette affection qui était constamment mortelle par la survenue d’une leucémie aigue. La Figure 2 montre une analyse rétrospective réalisée à MD Anderson Cancer Centre , montrant la survie des patients atteints de LMC selon les années de prise en charge, depuis les années avant 1975 jusqu’à nos jours: Cette analyse montre une augmentation spectaculaire de la survie des patients atteints de LMC depuis l’introduction de cette première thérapie ciblée, administrée par voie orale. Une étude plus récente réalisée en Suède, tenant compte de l’ensemble des progrès thérapeutiques montre qu’aujourd’hui, la survie des patients atteints de LMC est très proche de celle des sujets sains de même âge et du même sexe, avec un gain de survie apparaissant à tous les âges (Figure 2). La LMC est actuellement devenue une maladie chronique suivie en ambulatoire, avec la nécessité d’évaluer sous traitement, par des études moléculaires, la quantification du gène BCR-ABL qui est le marquer majeur à suivre. Cela nécessité la prise en charge dans un centre d’Onco-Hématologie spécialisé avec une infrastructure adaptée. Il est devenu cependant clair, au cours des années 2000, que certains patients développaient une intolérance ou une résistance à l’Imatinib (environ 30% des cas), ce qui a conduit, à la mise au point d’autres inhibiteurs de 2eme (Nilotinib, Dasatinib) puis de 3eme génération (Ponatinib). Ces thérapies, administrées également par voie orale sont de plus en plus puissants, entrainant des rémissions plus rapides et plus « profondes » comme cela est démontré par les suivis moléculaires. Le corollaire de cette efficacité est l’apparition des effets secondaires notamment vasculaires et métaboliques, qui nécessitent actuellement une prise en charge multidisciplinaire de la maladie avec une collaboration des hématologues avec les cardiologues, angiologues, pneumologues, diabétologues.. L’obtention des réponses moléculaires profondes permet actuellement, d’envisager des arrêts de traitement dans la cadre des essais thérapeutiques chez les patients chez qui le gène BCR_ABL n’est plus détectable pendant plus de 2 ans. Cet arrêt de traitement nécessite un suivi moléculaire strict notamment au cours des 6 premiers mois de l’arrêt. En effet, depuis les essais pionniers réalisés en France, tous les essais d’arrêt réalisés dans monde ont montré la survenue de rechutes de la leucémie dans 40-60% des cas, surtout dans les 6 premiers mois de l’arrêt du traitement. La détection précoce de la rechute permet la reprise du traitement, avec une réponse moléculaire qui est obtenue dans tous les cas. Les patients sans rechute, ont actuellement des rémissions sans traitement qui peuvent être très longues, mais le suivi moléculaire est toujours nécessaire dans un centre spécialisé. Les caractéristiques comparatives des patients avec ou sans rechute à l’arrêt de traitement sont également identifiées, permettant de proposer cette stratégie à des patients ayant le maximum de chances d’en bénéficier. Quelle est la raison de la récurrence de la maladie après l’obtention d’une rémission profonde ? Peut-on identifier des facteurs biologiques prédictifs de rechute ? Cela a été un sujet recherche dans plusieurs laboratoires dans le monde depuis plusieurs années
QUELS SONT LES ENJEUX DE LA RECHERCHE EN 2021 ?
La LMC est une maladie de la cellule souche hématopoïétique caractérisée par un potentiel de prolifération majeur. Il a également été montré que ces cellules pouvaient entre dans des périodes de dormance ou quiescence pendant plusieurs années. Notre Unité Inserm, puis d’autres centres de recherche dans le monde, ont montré que la persistance des cellules souches leucémiques était à l’origine des rechutes survenant à l’arrêt du traitement. Ces cellules sont difficiles à détecter au niveau du sang périphérique, car elles siègent au sein de la moelle osseuse dans un microenvironnement qui les protège de l’effet des thérapies qui sont par ailleurs inefficaces contre les cellules en dormance. Enfin, il est devenu rapidement clair que ces cellules pouvaient survivre en utilisant d’autres mécanismes de survie que ceux induits par la protéine BCR-ABL, qui est la cible des thérapies actuelles : la cellule souche leucémique peut donc survivre via d’autres mécanismes. Ces résultats ont stimulé des recherches pour identifier ces mécanismes de survie des cellules souches leucémiques et des moyens pour les inhiber, de manière à les éradiquer, en associant ces nouvelles thérapies avec les inhibiteurs de BCR-ABL. Plusieurs nouvelles thérapies ont été identifiées, qui permettraient ainsi d’éradiquer de manière définitive les cellules résistantes mais malgré l’identification de nouvelles molécules, aucun traitement additionnel n’a pu montrer son efficacité définitive, cela étant d’autant plus difficile que le but est d’éviter tous les effets secondaires potentiel de ces thérapies.
Les recherches cliniques sont en cours par ailleurs pour identifier les facteurs prédictifs de rechute à l’arrêt du traitement. Parmi ces facteurs, outre la gravité de la maladie au début (identifiée par des « scores ») on a identifié la durée de la thérapie ciblée (Plus de 5-6 ans de traitement) et la durée des rémissions profondes (au moins 2 ans) comme étant des éléments majeurs pour une probabilité sans rechute plus grande. Le système immunitaire pourrait également être un élément permettant de contrôler les cellules souches leucémiques , en effet la présence d’un nombre important de cellules immunitaires de type « natural killers » semble être un élément prédictif de non-rechute après arrêt de traitement. Enfin, des recherches en cours visent à identifier des facteurs de progression vers une leucémie aiguë, qui survient encore notamment chez les patients résistants aux thérapies ciblées.
CONCLUSIONS
La LMC continue à être en 2021, un modèle en Cancérologie : Un modèle de thérapie ciblée et d’immunothérapie, qui sont en plein essor et la voie initiée par la recherche dans cette maladie commence actuellement être appliquée aux autres hémopathies malignes considérées comme étant incurables, comme la leucémie lymphoïde chronique et le myélome multiple avec des résultats exceptionnellement encourageants.
- C'est uniquement grâce à vos dons que nous pouvons financer la recherche contre la leucémie myéloïde chronique pour permettre de combattre les résistances aux traitements et les rechutes et aider les patients atteints de cancer. Nous avons besoin de votre aide. "j'agis, je fais un don"
